Xibalbanus tulumensis : un crustacé venimeux fascinant des grottes sous-marines
Le Xibalbanus tulumensis, un crustacé venimeux que l’on trouve dans les grottes anchialines de la péninsule du Yucatán, est le seul crustacé pour lequel un système de venin a été décrit. Cette découverte ouvre de nouvelles perspectives sur les propriétés biologiques des venins marins.
La recherche sur le venin animal
« Les animaux venimeux injectent leurs composés toxiques dans d’autres organismes principalement pour se défendre ou pour la prédation », explique le Dr Björn von Reumont, chercheur à l’Université Goethe de Francfort. Selon lui et ses collègues, « de nombreux venins sont constitués de protéines qui ont évolué pour moduler une gamme de fonctions physiologiques chez leurs organismes cibles ». L’investigation de ces activités biochimiques pourrait mener à des applications pharmacologiques ou agrochimiques.
L’importance des venins marins
Bien que les venins et les protéines venimeuses aient été largement étudiés chez des groupes emblématiques et terrestres tels que les serpents, les araignées, les scorpions et les insectes, peu de recherches ont été consacrées aux espèces marines. Parmi celles-ci, seules quelques poissons et invertébrés comme les anémones de mer, les méduses, les escargots cônes et les céphalopodes ont suscité plus d’attention.
Étude de la bioactivité du venin d’Xibalbanus tulumensis
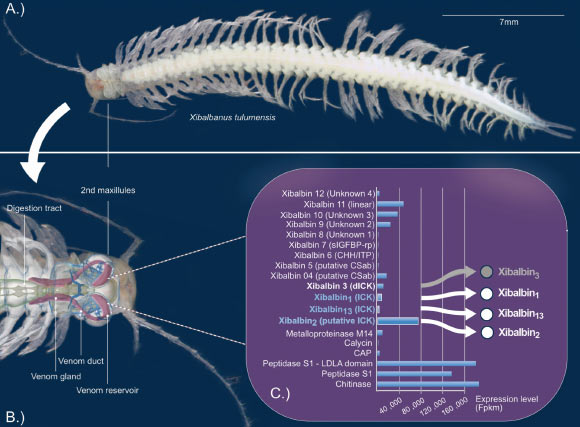
Dans leur étude, les chercheurs ont examiné la bioactivité des peptides présents dans le venin de l’espèce Xibalbanus tulumensis. Ce crustacé vivant dans les grottes aquatiques appartient à la classe des Remipedia, décrite pour la première fois dans les années 1980 et comptant actuellement 28 espèces vivantes.
« Xibalbanus tulumensis habite les cenotes, ces systèmes de grottes sous-marines situés sur la péninsule du Yucatán au Mexique », ajoutent les scientifiques. Cette espèce injecte le venin produit dans sa glande vénéneuse directement dans ses proies. Ce venin contient divers composants, dont un nouveau type de peptide, baptisé xibalbine, en référence à son producteur crustacé.
Les propriétés des peptides xibalbines
Certaines de ces xibalbines présentent un élément structurel caractéristique similaire à d’autres toxines, en particulier celles produites par les araignées : plusieurs acides aminés (cystéines) du peptide sont liés entre eux de manière à former une structure en nœud. Cela confère aux peptides une résistance aux enzymes, à la chaleur et à des valeurs extrêmes de pH.
Ces knottins agissent souvent comme neurotoxines, interagissant avec des canaux ioniques et paralysant les proies — un effet également proposé pour certaines xibalbines. La recherche révèle que tous les peptides xibalbines testés par l’équipe — en particulier Xib1, Xib2 et Xib13 — inhibent efficacement les canaux potassiques dans les systèmes des mammifères.
Implications pour la santé et la pharmacologie
« Cette inhibition est d’une grande importance pour le développement de médicaments contre diverses maladies neurologiques, y compris l’épilepsie », souligne le Dr von Reumont. De plus, Xib1 et Xib13 montrent la capacité d’inhiber les canaux sodiques voltage-dépendants, présents dans les cellules nerveuses ou musculaires cardiaques. Dans les neurones sensoriels des mammifères supérieurs, ces deux peptides peuvent activer des protéines — kinases PKA-II et ERK1/2 — impliquées dans la transduction du signal, ce qui suggère un rôle dans la sensibilisation à la douleur, ouvrant ainsi de nouvelles voies en thérapie de la douleur.
Publication des résultats
Les résultats de cette étude ont été publiés dans la revue BMC Biology.
E.L. Pinheiro-Junior et al., 2024. Variantes de xibalbine évoluées de manière diverse issues du venin de remipède inhibent les canaux potassiques et activent les voies de signalisation PKA-II et Erk1/2. BMC Biol 22, 164; doi: 10.1186/s12915-024-01955-5.